La alteración sistémica del cáncer en el cuerpo
Equipos del CSIC estudian las alteraciones provocadas por la progresión tumoral en los sistemas inmunitario, nervioso y circulatorio para buscar nuevas dianas terapéuticas
Equipos del CSIC estudian las alteraciones provocadas por la progresión tumoral en los sistemas inmunitario, nervioso y circulatorio para buscar nuevas dianas terapéuticas
Los tumores llegan a comportarse como auténticos órganos que interactúan con el huésped, es decir, el paciente. Esta interacción se produce en la propia célula, con el resto de componentes celulares normales que habitan en el tumor, y también llega a afectar a los sistemas inmunitario, nervioso y circulatorio, alterando el funcionamiento del organismo en su conjunto. Para buscar formas de combatirlo, es imprescindible desentrañar la interacción del cáncer a nivel sistémico.
“Estos procesos sistémicos incluyen la reprogramación metabólica de las células, la inflamación crónica como factor de riesgo de oncogénesis (incluyendo la influencia del microbioma), la interacción del tumor con los sistemas nervioso y vascular, y su relación con el sistema inmunitario”, enumera el investigador Raúl V. Durán, del Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER), y coordinador del reto Cáncer del Libro Blanco de Biomedicina del CSIC.
Varios equipos de diversos centros del CSIC están especializados en los diferentes abordajes del estudio de la respuesta sistémica del cáncer.
Matar de hambre al tumor
El equipo de Durán indaga en los procesos por los que las células cancerígenas reprograman el metabolismo de las células, es decir, el conjunto de reacciones químicas que les permiten obtener la energía y la materia para reproducirse. Las células tumorales crecen desorbitadamente y ocasionan un drenaje metabólico del huésped, pero para conseguirlo tienen que cambiar completamente su programa metabólico.
“Una de las características comunes de los tumores es que consumen mucha energía”, explica Durán. Su rápida proliferación requiere un gran consumo energético. “El mantenimiento de una tasa rápida y continua de proliferación celular, que es lo que forma el tumor, requiere un aporte de energía y biomasa tan considerable, que el tumor se ve obligado a cambiar el funcionamiento normal de su metabolismo celular”, añade el investigador.

El grupo de Inmunología y Oncología del CNB, dirigido por Ana Cuenda, analiza cómo el cáncer interactúa con el sistema inmunitario. / CNB
Entre estas modificaciones de la reprogramación metabólica destacan dos fundamentales: la absorción de azúcares y el consumo de aminoácidos. “Para mantener la producción de energía, las células tumorales absorben grandes cantidades de azúcares, principalmente glucosas; y para mantener la producción de biomasa (la materia de las células), las células tumorales consumen grandes cantidades de aminoácidos, las moléculas constituyentes de las proteínas, que son las piezas clave que forman tejidos y órganos”, enumera el investigador.
El conocimiento de estos mecanismos metabólicos podría aportar una vía para atacar la proliferación de las células tumorales. “De esta manera se recupera la vieja idea de matar al tumor de hambre, pero con mayor precisión: se trataría de aplicar restricciones específicas de aquellos nutrientes por los que las células tumorales muestren mayor avidez”, indica Durán. “De forma que la estrategia de ataque estaría más encaminada al desequilibrio nutricional del tumor, que a la restricción calórica”, detalla.
Además, el metabolismo tumoral, más allá de satisfacer las necesidades nutricionales de la célula proliferativa, se convierte también en un mecanismo fundamental en la desregulación del control del crecimiento celular, paso necesario para el desarrollo del cáncer, según explica Durán. “En consecuencia, conocer los mecanismos por los que el metabolismo tumoral se encuentra alterado en el cáncer, así como dilucidar la conexión bioquímica entre el metabolismo y la señalización celular, son pasos esenciales para poder proponer y validad terapias encaminadas a atacar específicamente dichos mecanismos en cada tipo tumoral”, argumenta el investigador.
“Ello nos llevaría una medicina personalizada en la que podamos proponer terapias efectivas (que eliminen células tumorales) y específicas (que no eliminen células no tumorales) atacando los hábitos alimenticios del tumor”, resume Durán.
El sistema circulatorio
El cáncer también altera el funcionamiento del sistema circulatorio. Es el caso de los linfomas y las leucemias, que se pueden definir como cánceres de la sangre. Los linfomas son una proliferación maligna de los linfocitos, que son las células del sistema inmunitario que defienden al organismo. Es un tipo de cáncer que se origina en el tejido linfático, encargado de devolver fluido desde los tejidos al sistema circulatorio (fluido intersticial, el que hay entre las células en todos los tejidos). El sistema linfático es parte del sistema circulatorio y del sistema inmunitario. Por su parte, las leucemias son un tipo de cáncer de la sangre que se origina en la médula ósea y consisten en la proliferación anormal de células sanguíneas.
En el Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM) centro mixto del CSIC y la Universidad Autónoma de Madrid, el equipo del investigador Miguel Ramón Campanero estudia los mecanismos de formación de leucemias y linfomas para desarrollar nuevas terapias para estos tumores. “Se han desarrollado terapias específicas para algunos tipos de linfomas y leucemias, pero estos tipos de tumores suelen contener células especialmente resistentes al tratamiento, conocidas como Células Iniciadoras de Tumores (CIT), que sobreviven y generan un nuevo tumor más resistente que el tumor inicial”, explica Campanero.
Una forma de atacar estos cánceres sería lograr terapias más eficaces contra estas células iniciadoras de tumores. “Una característica específica de las CIT, que las distingue de las células no tumorales y del resto de células cancerosas presentes en los tumores, es su elevada capacidad de proliferación cuando las cultivamos en medios gelatinosos en el laboratorio”, indica el investigador.
El equipo de Campanero se fija específicamente en el modo que tienen de proliferar las células de un tipo de linfoma en el medio gelatinoso. “Queremos analizar cómo contribuye cada proteína humana al crecimiento de este tipo de células”, señala el investigador, cuyo laboratorio cuenta con financiación de la Asociación Española contra el Cáncer (AECC). “De hecho, recientemente hemos identificado una proteína necesaria para la proliferación de células de leucemias y linfomas en medios gelatinosos y hemos descubierto que inhibiendo su expresión disminuimos drásticamente el crecimiento de estos tumores en un modelo animal”, precisa.
“Cuando obtengamos los datos sobre la aportación de cada proteína humana al crecimiento de estas células –adelanta Campanero– “determinaremos la contribución de algunas de estas proteínas al crecimiento de varios tipos de leucemias y linfomas en medios gelatinosos y emplearemos herramientas genéticas para bloquear su expresión y fármacos que inhiban su actividad para determinar su potencial terapéutico en modelos animales”.
El equipo de Campanero confía en que este trabajo permitirá identificar proteínas necesarias para la proliferación de las CIT y diseñar fármacos que las modulen. Esto facilitará el desarrollo de terapias para el tratamiento de los linfomas y las leucemias más específicas, con menos efectos secundarios, y menos propensas a la recaída que las actuales.
El sistema inmunitario
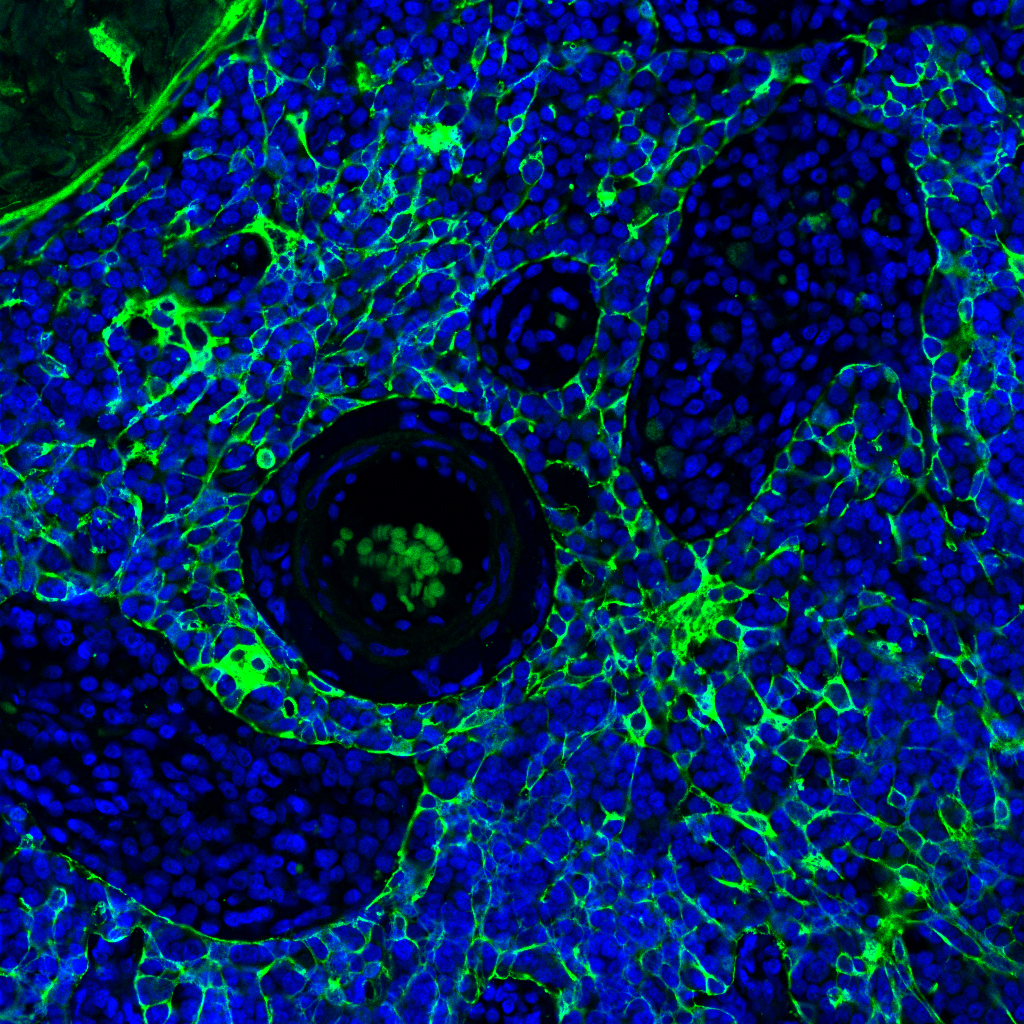
El cáncer también interactúa con el sistema inmunitario, que son las defensas del organismo contra cualquier patógeno o agente externo. En este sistema de defensas juega un papel central la inflamación. “La inflamación es la respuesta de defensa de nuestro cuerpo”, explica la bióloga Ana Cuenda, del Centro Nacional de Biotecnología (CNB-CSIC). “Es el arma más poderosa que tenemos para luchar contra las infecciones y, además, sirve para reparar nuestros tejidos cuando, por ejemplo, nos hacemos una herida”, añade.

Sección de colon de ratón con cáncer colorrectal, en el que se pueden visualizar los núcleos celulares (azul) y los linfocitos T (rosa). / CNB
“Si todo va bien y la inflamación se produce de una forma controlada, es beneficiosa. Sin embargo, si la inflamación se descontrola porque el sistema inmune funciona mal, entonces se producen enfermedades, como puede ser el cáncer”, advierte Cuenda.
El equipo de Cuenda investiga cómo la inflamación crónica puede influir en el desarrollo de tumores en ciertos órganos. Utilizan modelos de ratón para inducir cáncer de colon y colitis ulcerosa. “En ellos estudiamos por qué una inflamación crónica en el intestino, como las que padecen los pacientes con colitis ulcerosa o la enfermedad de Crohn, hace que se desarrollen tumores de colon en una proporción mucho más alta que en la población normal”, explica Cuenda.
“En nuestro laboratorio hacemos investigación básica para comprender cómo funcionan las moléculas y las células que están implicadas en estas enfermedades y qué es lo que falla cuando se produce la patología”, indica Cuenda. “De esta manera, hemos descubierto que unas moléculas llamadas p38 son importantes en estas enfermedades. Estas proteínas actúan como mensajeros celulares para transmitir la información desde el exterior de las células a su interior, haciendo que respondan a diferentes estímulos. Por ejemplo, producen una respuesta inflamatoria si hay una infección o un daño al tejido”, detalla la investigadora.
Su equipo ha mostrado que, si eliminan o inhiben las proteínas p38 en el colon de los ratones, reducen drásticamente la inflamación y también el desarrollo de tumores en el colon. “Analizando en detalle el mecanismo que está detrás de este descubrimiento, hemos observado que estas proteínas p38 regulan tanto el reclutamiento de células del sistema inmune -como neutrófilos o macrófagos [dos tipos de células inmunitarias que devoran partículas dañinas, como bacterias o células moribundas] para que se dirijan a los focos de inflamación-, como la producción de citoquinas, que son moléculas secretadas que orquestan la respuesta inmunitaria”, señala Cuenda.
Como las proteínas p38 son esenciales para la inflamación, el equipo de Cuenda considera que en el futuro podrían usarse fármacos que bloqueen la actividad de estas proteínas para tatar enfermedades inflamatorias y también el cáncer, controlando una respuesta inflamatoria exagerada.
El sistema nervioso
El cáncer también interacciona con el sistema inmunitario a través del sistema nervioso. Es el caso del glioblastoma multiforme, la forma más frecuente y agresiva de cáncer cerebral, que tiene una supervivencia media de 14-15 meses después del diagnóstico. En el Instituto de Neurociencias de Alicante (IN-CSIC-UMH), mixto del CSIC y la Universidad Miguel Hernández, el laboratorio del investigador Salvador Martínez investiga los mecanismos de este tipo de tumores cerebrales.
“Durante el desarrollo del glioblastoma multiforme, las células tumorales infiltran e invaden el parénquima [tejido] cerebral interactuando con las células de los vasos cerebrales. Los vasos cerebrales están compuestos por pericitos [un tipo de células] y células endoteliales. Los pericitos controlan múltiples funciones neurovasculares y de defensa inmunológica en respuesta al daño cerebral”, explica Martínez.
Su investigación ha observado cómo las células tumorales del glioblastoma logran alterar la función defensiva de los pericitos. “En nuestro laboratorio hemos demostrado que la función immunoprotectota de los pericitos está reprimida por su interacción directa con las células del glioblastoma y que estos contribuyen al establecimiento de inmunotolerancia al crecimiento tumoral”, explica el investigador.
Las células tumorales también consiguen alterar otros mecanismos del sistema vascular para acceder al cerebro. “Hemos descrito también que la autofagia mediada por chaperonas, un proceso celular implicado en la degradación de proteínas, está marcadamente activada en los pericitos de los vasos por los que el tumor infiltra el cerebro sano”, detalla Martínez.
Este mecanismo podría proporcionar una estrategia de ataque a los tumores. “La inhibición de la autofagia mediada por chaperonas en los pericitos promueve la muerte de células cancerosas del glioblastoma por la liberación de altos niveles de proteínas antitumorales y la activación de la respuesta inmune”, indica el investigador.
Los hallazgos del grupo de Martínez han identificado este procedimiento —la autofagia mediada por chaperonas— como un mecanismo por el cual las células del glioblastoma inducen una función inmunosupresora en los pericitos que es necesaria para la supervivencia de las células tumorales. “De este modo, abre la posibilidad de apuntar a este proceso para buscar nuevos tratamientos para esta grave enfermedad”, concluye Martínez.
Abel Grau / CSIC Comunicación
Noticias relacionadas
Un equipo liderado por Analia Bortolozzi, investigadora…
Un estudio del Instituto de Biología Integrativa de Sistemas (I2SysBio,…
Un equipo del Instituto de Micro y Nanotecnología (IMN-CNM) del Consejo…