Un equipo del CSIC identifica el mecanismo de la respuesta inmune en la cavidad peritoneal frente a infecciones bacterianas
Agregados de macrófagos peritoneales, con linfocitos B y neutrófilos, crean un microambiente crucial para controlar las infecciones abdominales
Agregados de macrófagos peritoneales, con linfocitos B y neutrófilos, crean un microambiente crucial para controlar las infecciones abdominales
Un equipo del CSIC ha identificado el mecanismo de activación de la respuesta inmune de la cavidad peritoneal (el espacio entre la pared y los órganos abdominales) frente a infecciones bacterianas. El estudio describe cómo la formación de agregados de macrófagos peritoneales crea un microambiente crucial para el control de las infecciones. Los macrófagos son células que pueden reconocer y eliminar células tumorales, microbios, restos celulares o sustancias extrañas.
La cavidad peritoneal está expuesta a graves patologías, como la sepsis y la metástasis de tumores derivados de cáncer de ovario, gástrico y colorrectal, por lo que es crucial conocer cómo el sistema inmune de la cavidad peritoneal responde ante dichas enfermedades. Esta investigación, publicada en la revista Immunity, ayuda a comprender cómo el sistema inmune responde de manera localizada frente a dichas enfermedades abdominales.
“La sepsis se caracteriza por una respuesta desregulada del sistema inmune ante una infección y es una de las principales causas de fallecimiento en todo el mundo”, explica Carlos Ardavín, investigador del CSIC en el Centro Nacional de Biotecnología (CNB-CSIC), quien ha liderado el grupo de investigación de este estudio. “Conocer los mecanismos de esta respuesta inmune es fundamental para poder combatir estas infecciones abdominales”, añade.
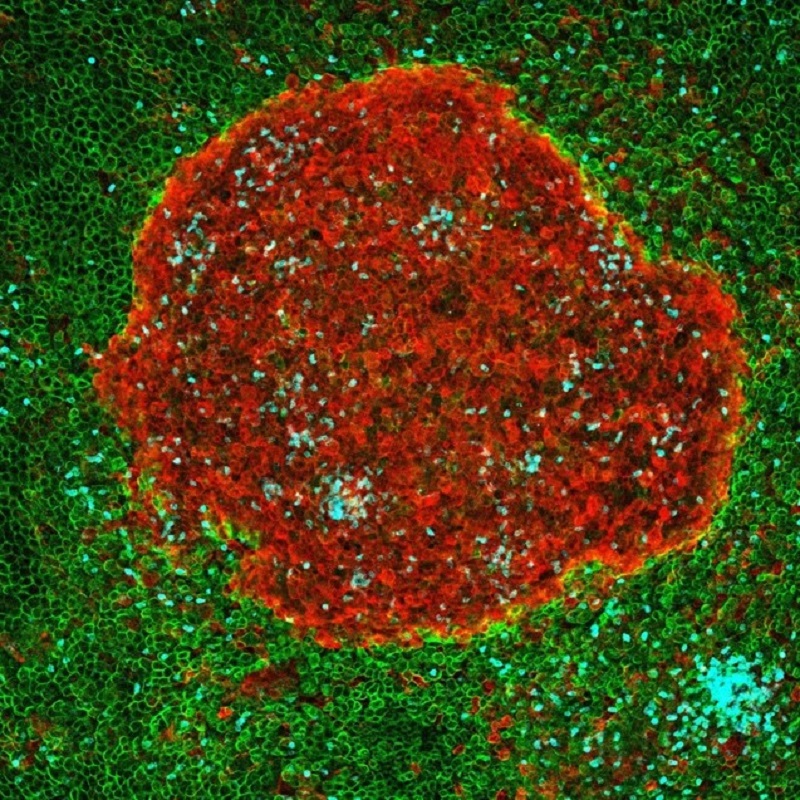
María López-Bravo, codirectora del trabajo junto a Ardavín en el CNB-CSIC, apunta: “durante la sepsis peritoneal, los macrófagos eliminan las bacterias y este proceso se asocia con la formación de agregados multicelulares en el mesotelio que cubre la cavidad peritoneal”.
En este trabajo, mediante técnicas de microscopía confocal y citometría de flujo, “hemos caracterizado en detalle estas estructuras, y las hemos denominado resMØ-aggregates (del inglés: “resident macrophage aggregates”). “Estos agregados, que contienen también linfocitos B y neutrófilos, son estructuras dinámicas cruciales para controlar las infecciones en la cavidad peritoneal, ya que crean un microambiente en el que las células pueden realizar sus funciones antimicrobianas”.
Adrián Vega-Pérez y Laura Hernández Villarrubia, coautores del trabajo, explican cómo estas estructuras dependen de la formación de una red de fibrina (una proteína fibrosa que forma, junto con las plaquetas, los coágulos sanguíneos) por activación de un proceso de coagulación extravascular, controlado por las células mesoteliales que cubren la cavidad peritoneal. Una vez controlada la infección, los macrófagos peritoneales participan en la eliminación de células muertas presentes en el interior de los agregados, y contribuyen a la desintegración de éstos por un proceso de fibrinólisis (degradación de la fibrina para deshacer los coágulos sanguíneos).
Ardavín destaca el cambio en la localización de los macrófagos, que en condiciones normales se encuentran libres en el fluido peritoneal, y pasan a formar los agregados, proporcionando así un soporte que facilita la interacción y la función de las células inmunitarias. Además, “la relevancia de la presencia de estas estructuras en la cavidad peritoneal abre un nuevo paradigma sobre la organización del sistema inmune de las diferentes cavidades corporales, y sugiere que podrían existir estructuras similares a las descritas en otras cavidades como la cavidad pleural o los ventrículos cerebrales con un papel crucial en la defensa frente a infecciones, un conocimiento clave para el desarrollo de nuevas terapias”.
CNB-CSIC Comunicación
Vega-Pérez A, Villarrubia LH, Godio C, Gutiérrez-González A, Feo-Lucas L, Ferriz M, Martínez-Puente N, Alcaín J, Mora A, Sabio G, López-Bravo M, Ardaví. Resident macrophage-dependent immune cell scaffolds drive anti-bacterial defense in the peritoneal cavity. Immunity. DOI: 10.1016/j.immuni.2021.10.007
Noticias relacionadas
Un equipo del Centro Nacional de Biotecnología (…
Un equipo liderado por el Centro de Astrobiología (…
El Consejo Superior de Investigaciones Científicas (CSIC), organismo…