Cinta Porte: “Desarrollamos modelos in vitro para evaluar la toxicidad de los contaminantes de manera más ética”
La investigadora del CSIC desarrolla modelos celulares en tres dimensiones como alternativa al uso de animales en ensayos de toxicidad ambiental
La investigadora del CSIC desarrolla modelos celulares en tres dimensiones como alternativa al uso de animales en ensayos de toxicidad ambiental
Desde hace décadas, la investigación biomédica busca métodos más éticos que reduzcan el uso de animales de laboratorio. En esta línea, la científica del Instituto de Diagnóstico Ambiental y Estudios del Agua (IDAEA-CSIC) está especializada en ecotoxicología y contaminación ambiental, y desarrolla esferoides hepáticos de pez cebra que pueden utilizarse para estudiar los efectos de contaminantes emergentes, así como de micro y nanoplásticos, a nivel celular. Se trata de cultivos celulares tridimensionales (3D) de células del hígado de pez cebra, modelo animal utilizado en biomedicina, creados para simular la estructura y función de un órgano real en un entorno de laboratorio.
Su objetivo: disponer de herramientas in vitro más fiables y robustas que permitan evaluar el impacto de los contaminantes ambientales en la salud sin recurrir a la experimentación animal.
Pregunta. ¿Por qué habéis elegido trabajar con estos modelos en 3D de hígado y qué ventajas ofrecen?
Respuesta. El hígado es el órgano metabólico por excelencia y, por tanto, es clave para estudiar el efecto de los contaminantes en el organismo. Algunos contaminantes llegan al hígado y se metabolizan dando lugar a compuestos menos tóxicos que se excretan. Sin embargo, hay otros contaminantes que en el hígado se metabolizan a compuestos más tóxicos que el compuesto inicial, por lo que resulta especialmente interesante estudiar este órgano. En nuestro laboratorio, utilizamos esferoides que básicamente son un conjunto de células en tres dimensiones. Este modelo en 3D es más realista para realizar estudios de toxicidad porque las células de fuera están más expuestas que las de dentro al compuesto que queramos analizar. Además, las células tienen mayor comunicación entre ellas, son más activas metabólicamente, lo que hace que estos modelos se asemejen más a la situación fisiológica de un organismo real.
P. ¿Cómo se reproduce un órgano tan complejo como el hígado en el laboratorio?
R. Realmente nosotras no estamos reproduciendo el hígado como tal, sino haciendo crecer en tres dimensiones un tipo de células hepáticas. Ahora estamos en el primer nivel, trabajando con un único grupo celular. Otros laboratorios sí que intentan reproducir el hígado; lo hacen a través de células pluripotenciales que dan lugar a diferentes tipos celulares y, por tanto, a un modelo más fidedigno del órgano. Pero estos modelos sólo se están desarrollando para estudios humanos, todavía tienen que incorporarse en el área de la toxicología ambiental.
Para desarrollar los esferoides en 3D, nosotras sembramos las células hepáticas en unas placas especiales que hacen que las células no se peguen al fondo y, en un proceso de 2-3 días, éstas se reestructuran de forma natural hasta formar una esfera. Una vez formados, los esferoides pueden mantenerse entre 20 y 30 días, lo que permite realizar experimentos crónicos (dosis bajas del tóxico durante un tiempo prolongado).
Todos los esferoides tienen el mismo número de células. Si generamos esferoides muy grandes, las células del interior no reciben oxígeno y nutrientes, y se forma una zona necrótica. En este caso, los esferoides son útiles para la investigación sobre cáncer ya que, en un tumor, normalmente hay una zona necrótica en el interior donde prácticamente no llega el oxígeno. Sin embargo, en toxicología ambiental lo que nos interesa es tener un esferoide con todas las células vivas y sanas, y por eso realizamos experimentos de optimización que nos indican el número óptimo de células para obtener un esferoide con todas las células viables.
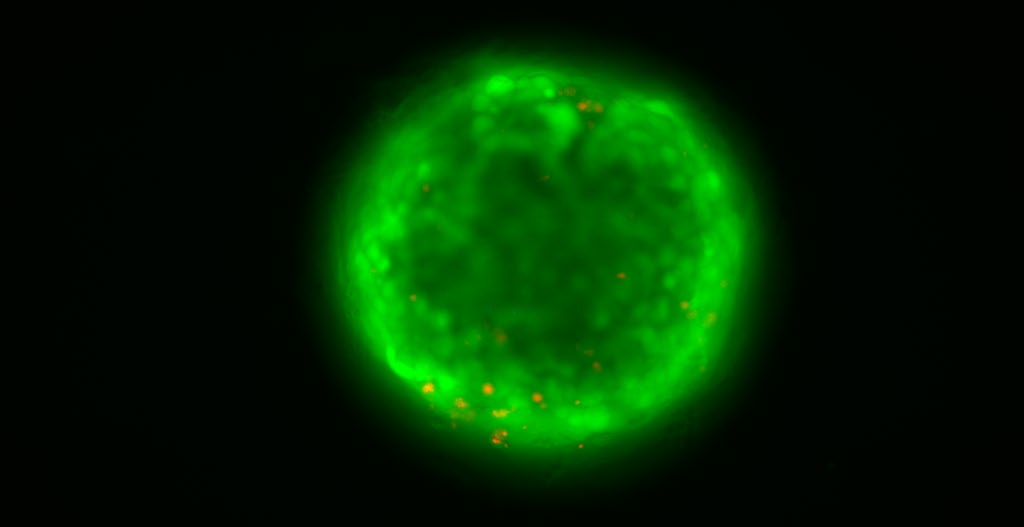 |
| Esferoide de células hepáticas que muestra las células viables (verde) y las no viables (rojo):. / Cinta Porte (IDAEA-CSIC) |
P. Vuestro trabajo se centra en el perfil lipídico. ¿Qué nos pueden contar los lípidos sobre los efectos de los contaminantes ambientales?
R. Los lípidos desempeñan un papel esencial en las células. Por ejemplo, forman parte de las membranas celulares, sirven para almacenar energía y, en ocasiones, secuestran tóxicos lipófilos, evitando que entren en contacto con otras moléculas o estructuras vitales para las células. También actúan como moléculas de señalización o en procesos de inflamación. Por tanto, si vemos cambios en el perfil lipídico (concentraciones de distintos tipos de lípidos en las células), éstos conllevan a menudo modificaciones muy significativas a nivel de funcionamiento celular. Nosotras ahora mismo estamos trabajando con micro y nanoplásticos. Nos interesa comprobar si la exposición a estas partículas altera la estructura y función celular.
P. ¿Qué nos puedes decir sobre el impacto de los micro y nanoplásticos a nivel celular?
R. Existe una gran evidencia científica que demuestra que los nanoplásticos inducen cambios en los lípidos de las membranas celulares y, a dosis elevadas, pueden inducir la acumulación de triglicéridos en el interior celular. A nivel de la salud humana, actualmente se describen problemas de hígado graso y otros problemas hepáticos. Ahora la cuestión es dilucidar hasta qué punto estos problemas provienen, y hasta qué grado, de causas ambientales como puede ser la contaminación por plásticos.
P. ¿Qué ventajas tienen estos modelos in vitro frente al uso de animales de experimentación? ¿Se podría llegar a hacer ciencia sólo con modelos in vitro?
R. Debemos desarrollar modelos in vitro al máximo nivel para evaluar la toxicidad de los contaminantes de manera más ética. El objetivo es avanzar hacia una experimentación basada íntegramente en modelos in vitro. Para que un contaminante tenga un efecto, la primera interacción que tiene con el organismo es a nivel celular. Y esa primera interacción da lugar a unos resultados. Si fuéramos capaces de detectar esas consecuencias a nivel de laboratorio, solo con modelos in vitro, y asociarlos mediante estudios ya existentes con cambios fisiológicos o metabólicos a nivel de organismo, tendríamos una herramienta muy potente.
Primero observaríamos los efectos a nivel celular y/o metabólico, y después podríamos extrapolar dichos efectos al organismo entero, lo que reduciría de forma significativa el uso de animales de laboratorio. Es decir, ya tenemos mucho conocimiento sobre los efectos de los tóxicos en animales de experimentación. Ahora se está investigando mucho con modelos in vitro, desarrollando proyectos más fieles a la realidad. Por tanto, tenemos que integrar todos estos niveles de conocimiento: celular, alteraciones en organismos de experimentación y salud humana para extraer las relaciones causales y, si no existe evidencia, diseñar nuevos experimentos que faciliten esta conexión.
P. La mayor crítica a los modelos in vitro como única vía de experimentación es que lo que sucede a nivel celular no tiene por qué ser igual que en todo el organismo. ¿Cómo lo abordáis?
R. Bueno, es cierto que para muchos contaminantes la extrapolación entre los efectos celulares y los efectos fisiológicos o a nivel del organismo completo es más compleja. Pero hay muchos compuestos tóxicos para los que sí podemos predecir con bastante exactitud qué efectos van a tener a mayor escala, analizando los efectos celulares. Claramente, si un compuesto no provoca efectos a nivel celular, no los va a generar a nivel de organismo. Los modelos in vitro tienen un valor incalculable como herramienta de screening (cribado) y actualmente se están infrautilizando.
P. ¿Los esferoides podrían aplicarse ya en estudios de toxicología ambiental?
R. En general, falta armonizar los métodos entre distintos laboratorios. Además, es necesario adaptar muchos de los métodos clásicos utilizados en modelos 2D a modelos 3D, como los esferoides. Es decir, en 2D hay muchos métodos fáciles ya establecidos (fluorescencia, absorbancia, etc.) que permiten detectar efectos de contaminantes en proteínas, enzimas, lípidos, ADN o ARN, pero estas técnicas hay que adaptarlas para que funcionen en modelos 3D, donde se trabaja con muchas menos células. Por este motivo, todavía existen pocas metodologías validadas para estudios de toxicología en 3D, y a menudo dependemos de observaciones al microscopio y tinciones para visualizar los efectos, pero necesitamos más herramientas.
Por otra parte, los esferoides finales que hemos desarrollado tienen unas 2000 células; parecen muchas, pero son pocas para ciertos análisis, como los de lipidómica (estudio del perfil de lípidos de una célula), que requieren al menos un millón de células para realizar estudios estadísticamente fiables. Por tanto, debemos producir un gran número de esferoides para poder realizar estos estudios. Esta es una de las limitaciones actuales del método, y un reto que debemos superar para que sea viable a corto y medio plazo.
Alicia Arroyo / IDAEA-CSIC Comunicación

Noticias relacionadas
Una investigación española liderada por el Consejo Superior de…
Un estudio liderado por Emiliano Bruner,…
Cuando una célula muere, el organismo se deshace de ella para evitar su…