La potencia energética de las células tubulares es clave para combatir la fibrosis renal
Científicos del CSIC han observado en modelos de ratón que existe protección frente a la fibrosis cuando las células tubulares se mantienen en un estado metabólico óptimo
Un equipo liderado por investigadores del Consejo Superior de Investigaciones Científicas (CSIC) ha descubierto que la mejora en la capacidad energética de las células tubulares renales protege al riñón de la formación de tejido fibroso, un proceso que subyace a enfermedades como la nefropatía diabética, la nefropatía hipertensiva o el riñón envejecido y que suponen etapas finales de la enfermedad renal crónica. Los resultados aparecen publicados en la revista Journal of Clinical Investigation.
La fibrosis es la sustitución de tejido celular funcional por proteínas de matriz extracelular como el colágeno. Es un proceso que puede darse en cualquier órgano, como el pulmón, el hígado o la piel. Los mecanismos de su producción son comunes y afectan, si se tienen en cuenta todos los órganos, a una de cada cuatro personas en el mundo.
Un problema metabólico
“Las células tubulares son células epiteliales (las que recubren todas las superficies libres del organismo, y revisten el interior de las cavidades, órganos huecos, conductos del cuerpo, mucosas y glándulas) especializadas que presentan microvellosidades dispuestas hacia la luz de un túbulo”, explica el investigador del CSIC Santiago Lamas, del Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM).
“En el caso del riñón, estas estructuras crean una superficie amplia a través de la cual se lleva a cabo la reabsorción y secreción selectiva de agua, iones y nutrientes orgánicos de un primer filtrado sanguíneo”, añade el investigador. “Se trata de procesos que requieren grandes cantidades de energía y que conducen finalmente a la formación de la orina. Esta organización funcional del riñón en pequeñas unidades de filtración y depuración permite recuperar sustancias útiles y facilitar la eliminación de sustancias nocivas del organismo”, detalla.
Unida a la mejora de la capacidad energética de estas células, los científicos han observado en diferentes modelos experimentales de ratón que existe “una protección significativa” frente al desarrollo de la fibrosis. Lo han comprobado mediante la sobreexpresión de una proteína enzimática mitocondrial, Cpt1a, que permite que los ácidos grasos de cadena larga puedan entrar en las mitocondrias.
“El metabolismo de los ácidos grasos dentro de la mitocondria confiere un gran poder bioenergético, al generar una gran cantidad de trifosfato de adenosina o ATP y mantener a las células epiteliales en un estado óptimo para defenderse de la inflamación crónica, origen principal de la fibrosis. En dos cohortes de pacientes con enfermedad renal crónica, pudimos comprobar el acúmulo de metabolitos derivados de unos bajos niveles de Cpt1a”, subraya la investigadora del CSIC Verónica Miguel, autora principal del trabajo.
Aunque no existen activadores específicos de este enzima, hay fármacos disponibles que permiten mejorar el metabolismo de las células renales, algunos en fase de estudio. La investigadora del CSIC añade: “Un mensaje central de este trabajo es que la fibrosis es también un problema metabólico, quizá esencialmente, y que la modificación del metabolismo es una vía eficaz para combatir esta enfermedad”.
“La prevalencia de la enfermedad renal crónica ha crecido casi un 30% en los últimos diez años, hasta situarse en casi 1.300 pacientes por millón de población y es una causa importante de morbilidad y gasto médico y social, ya que requiere tratamiento sustitutivo crónico o trasplante. En un gran número de casos, esta enfermedad es la evolución final de patologías donde subyace la fibrosis”, concluye Lamas.
CSIC Comunicación
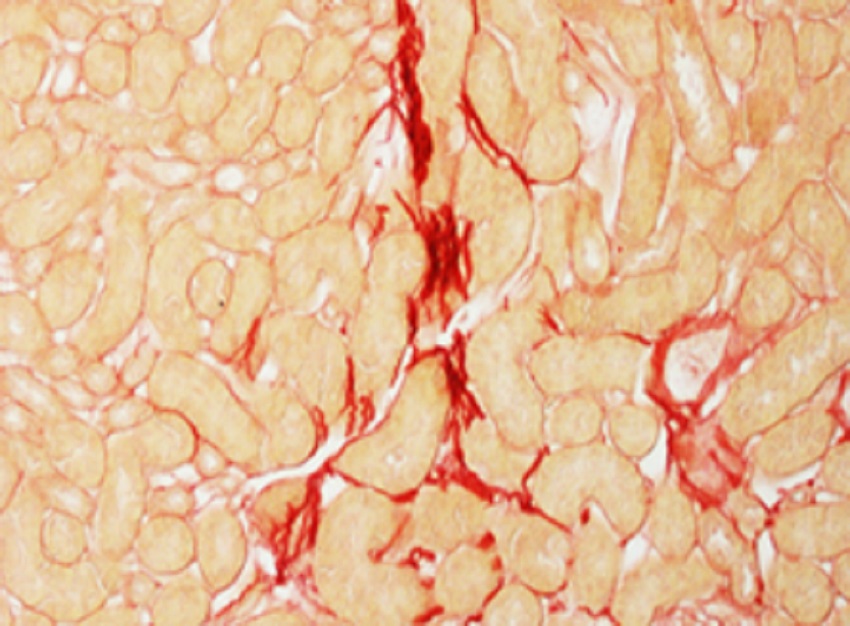
Verónica Miguel et al. Renal tubule Cpt1a overexpression protects from kidney fibrosis by restoring mitochondrial homeostasis. Journal of Clinical Investigation. DOI: 10.1172/JCI140695
Noticias relacionadas
“La medicina cura al hombre, la medicina veterinaria cura a la humanidad…
El desarrollo de la corteza cerebral depende en gran medida de las células…