Descifrado el mecanismo de acción de una proteína presente en bacterias patógenas "muy peligrosas"
Un equipo internacional liderado por una investigadora del Consejo Superior de Investigaciones Científicas (CSIC) ha estudiado una novedosa proteína que existe, de manera exclusiva, en algunas bacterias anaerobias, aquellas capaces de vivir en ambientes carentes de oxígeno. Los resultados del trabajo, que profundiza en las “propiedades únicas” de esta proteína presente en bacterias consideradas patógenos “muy peligrosos”, abre las puertas a la búsqueda de nuevas moléculas con actividad antibiótica.
Esta investigación, publicada en el último número de la revista Proceedings of the National Academy of Sciences of the United States of America (PNAS), supone la primera evidencia de que algunas bacterias que viven en ambientes que carecen de oxígeno, en los cuales no están tampoco expuestas a la luz, utilizan mecanismos metabólicos que hasta ahora se pensaba que eran exclusivos de los organismos fotosintéticos, como las algas y las plantas.
“Desde el punto de vista biomédico, el estudio presenta aún más relevancia si cabe, porque algunas de las bacterias en las que se encuentra esta proteína son patógenos extremadamente peligrosos, entre los que se incluyen Clostridium difficile, Clostridium botulinum y Clostridium tetani, causantes de la colitis pseudomembranosa, el botulismo y la enfermedad del tétanos, respectivamente”, detalla la investigadora del CSIC Mónica Balsera, que trabaja en el Instituto de Recursos Naturales y Agrobiología de Salamanca.
En concreto, la proteína estudiada es quimera de dos proteínas diferentes: la Tiorredoxina Reductasa dependiente de NADPH (NTR), que está presente en todos los organismos vivos conocidos, y la Tiorredoxina Reductasa dependiente de Ferredoxina (FTR), que es exclusiva de los organismos fotosintéticos. “La proteína resultante, denominada Flavín-Tiorredoxina Reductasa dependiente de Ferredoxina (FFTR), es especial porque contiene una mezcla inédita de las funcionalidades de las dos proteínas iniciales”, precisa Balsera, responsable de la investigación.
Para llevar a cabo este estudio, ha sido clave la obtención de la estructura tridimensional de la proteína con una resolución atómica, que se ha conseguido mediante experimentos de difracción de rayos-X de alta energía, realizados en los sincrotrones ALBA (Barcelona) y Diamond (Oxford, Reino Unido).
“Existe una multitud de variantes de las reacciones metabólicas que ocurren en los seres vivos. Dada su relevancia, la gran mayoría de los procesos metabólicos han sido estudiados y caracterizados de manera extensiva durante las últimas décadas. No obstante, aún es posible encontrar, tal y como demuestra nuestra investigación, nuevas variedades de procesos metabólicos en determinados organismos”,
Además del Instituto de Recursos Naturales y Agrobiología de Salamanca, el estudio ha contado con la participación de investigadores de la Universidad de California en Berkeley y de la Universidad de Neuchâtel (Suiza), así como del Instituto de Biología Celular y Molecular del Cáncer (CSIC) y del Grupo de Ingeniería Metabólica de la Universidad de Salamanca.
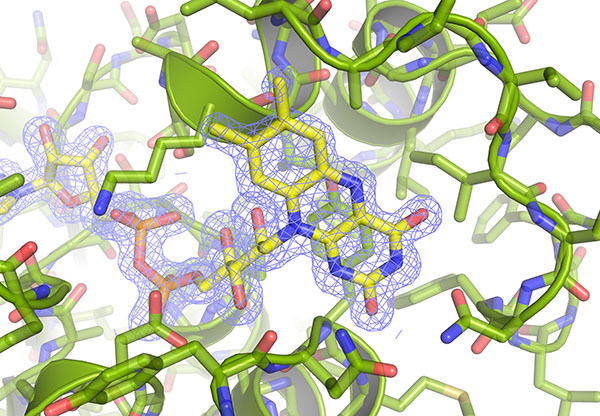
- Rubén M Buey, David Fernández-Justel, José M de Pereda, José L Revuelta, Peter Schürmann, Bob B Buchanan and Mónica Balsera. A Ferrodoxin-Linked Flavoenzyme Defines a Family of Pyridine Nucleotide-Independent Thioredoxin Reductases. PNAS. DOI: 10.1073/pnas.1812781115
Noticias relacionadas
El Consejo Superior de Investigaciones Científicas (CSIC), el mayor…
Una investigación liderada por científicos del Consejo Superior de…
El Instituto de Biomedicina de Sevilla (…